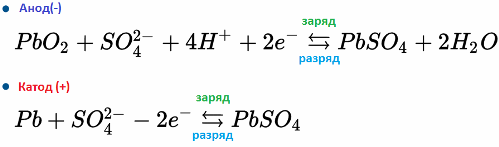Kategorie: Jak to działa, Elektryk samochodowy
Liczba wyświetleń: 16526
Komentarze do artykułu: 0
Urządzenie i zasada działania baterii
Bateria elektryczna nazywa się źródło prądu chemicznego wielokrotnego użytku. Procesy chemiczne wewnątrz akumulatora, w przeciwieństwie do procesów w jednorazowych ogniwach galwanicznych, takich jak baterie alkaliczne lub solne, są odwracalne. Cykle rozładowania, akumulacji i zwrotu energii elektrycznej można powtarzać wiele razy.
Tak więc zasada działania baterii pozwala na cykliczne wykorzystywanie jej do autonomicznego zasilania różnych urządzeń, urządzeń przenośnych, pojazdów, sprzętu medycznego itp. W zupełnie innych obszarach.

Mówiąc słowo „bateria”, oznaczają one samą baterię lub ogniwo baterii. Kilka szeregowo lub równolegle połączonych ze sobą ogniw akumulatora tworzy akumulator, a także kilka połączonych akumulatorów.
Pierwsza bateria, czyli ogniwo galwaniczne wielokrotnego użytku, pojawiła się, według oficjalnych danych, w 1803 roku. Został stworzony przez niemieckiego fizyka i chemika Johanna Wilhelma Rittera. Przyjaciel Oersteda, Ritter, nie będąc naukowcem, badał chemiczny wpływ światła, przeprowadzał eksperymenty z elektrolizą, nawiasem mówiąc, należy do odkrycia części ultrafioletowej spektrum elektromagnetycznego.
Eksperymentując z kolumną woltaiczną, Ritter wziął pięćdziesiąt kręgów miedzi, kawałków mokrej tkaniny i utworzył między nimi kolumnę pięćdziesięciu takich kół i mokrej tkaniny. Przepuszczając prąd z kolumny voltaicznej przez strukturę, Ritter odkrył, że jego biegun został naładowany i sam stał się źródłem elektryczności. To była pierwsza bateria.
Odwracalność reakcji chemicznej w elektrolicie i na elektrodach akumulatora pozwala przywrócić sprawność akumulatora - naładować go po rozładowaniu. Prąd podczas ładowania przepływa przez akumulator w kierunku przeciwnym do rozładowania.
Na przykład akumulator ołowiowo-kwasowy działa z powodu reakcji elektrochemicznych ołowiu i dwutlenku ołowiu w kwasie siarkowym. Poniższe wzory odzwierciedlają odwracalne reakcje zachodzące na anodzie i na katodzie: od lewej do prawej - reakcja podczas rozładowania, od prawej do lewej - ładunek.
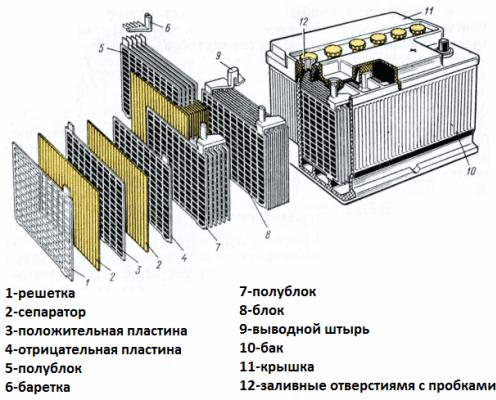
Rozważ teraz urządzenie akumulatorowe jako przykład akumulatora rozruchowego samochodu. Jego napięcie wynosi 12 woltów. Bateria składa się z sześciu ogniw połączonych szeregowo, oddzielonych przegrodami.
Połączenie szeregowe w tym przypadku oznacza, że ujemny zacisk jednej komórki jest podłączony do dodatniego bieguna drugiej komórki.
Każdy element zawiera parę elektrod kratowych ze stopu ołowiu i antymonu zanurzonych w elektrolicie, który jest 38% wodnym roztworem kwasu siarkowego. Porowaty separator izoluje elektrody od siebie, zapobiegając zwarciom między nimi, ale swobodnie przepuszcza elektrolit przez siebie. Oznacza to, że ciecz wypełnia zarówno komórki płytek ołowiowych, jak i pory separatorów.
Płytki o tej samej nazwie są połączone zworkami ołowiu, a także pakiety płyt oddzielone przegrodami, które tworzą poszczególne elementy, a zaciski akumulatora są również wykonane z ołowiu.
Wnioski z akumulatora samochodowego zawsze mają nieco inny rozmiar - zacisk dodatni ma większą średnicę niż zacisk ujemny, aby nie popełnić błędu podczas podłączania.
Obudowa baterii wykonana jest z materiału dielektrycznego odpornego na agresywne środowisko, ekstremalne temperatury i wibracje. Obecnie skrzynki na akumulatory rozruchowe są wykonane z polipropylenu.
Obudowa to hermetycznie zamknięty pojemnik z pokrywką, wyposażony w kołnierze do trwałego montażu.W przypadku starych baterii zawsze przewidziano wtyczki do każdego ogniwa galwanicznego, które tworzą baterię, aby w razie potrzeby można było dodać wodę destylowaną. Nowoczesne bezobsługowe wtyczki akumulatorów w obudowach nie mają.
Inne artykuły o bateriach i ich użyciu:
Schematy podłączenia akumulatora
Jakie są baterie do elektrowni słonecznych
Zobacz także na electro-pl.tomathouse.com
: